Weichen neu gestellt – Neuartiger Behandlungsansatz für Weichteiltumore
Durch die gezielte Veränderung der Tumorzellen hin zu Muskelzellen gelang es ihnen, das Wachstum der Zellen und damit auch die Ausbreitung des Tumors zu stoppen. Daraus ergeben sich völlig neue Therapiemöglichkeiten bei der Krebsbehandlung.
Das Rhabdomyosarkom, ein bösartiger Tumor, ist einer der häufigsten Weichteiltumore im Kindesalter. Die Tumore sind mit der Skelettmuskulatur assoziiert und können überall im Körper entstehen. Folglich ist das Krankheitsbild sehr vielfältig und eine vollständige Entfernung der Tumore durch deren Lage oft schwierig bis nahezu unmöglich, weshalb intensiv nach alternativen Behandlungsansätzen geforscht wird.
Ein Team um Prof. Julia von Maltzahn, ehemals Forschungsgruppenleiterin am Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) und nun als Professorin für Stammzellbiologie des Alters an der Brandenburgischen Technischen Universität Cottbus-Senftenberg (BTU) tätig, hat einen neuartigen Behandlungsansatz für Rhabdomyosarkome entdeckt, der als Ergänzung zur traditionellen Chemo- und Strahlungstherapie bei dieser Tumorerkrankung eingesetzt werden könnte. Durch die gezielte Veränderung der Tumorzellen zu Muskelzellen gelang es ihrem Team, das Wachstum der Zellen und damit auch der Tumore zu stoppen. Die Forschungsergebnisse sind jetzt in der renommierten Fachzeitschrift „Molecular Therapy“ erschienen.
Erhöhter TRPS1-Spiegel bei Weichteiltumoren
Rhabdomyosarkome können als zwei Subtypen auftreten, als alveolärer und embryonaler Subtyp. Beim embryonalen Subtyp sind die molekularen Ursachen für das Fortschreiten des Tumors bisher weitgehend unbekannt oder sehr divers, was die Entwicklung therapeutischer Ansätze erschwert. Man nimmt an, dass die Tumore aus Muskelvorläuferzellen entstehen.
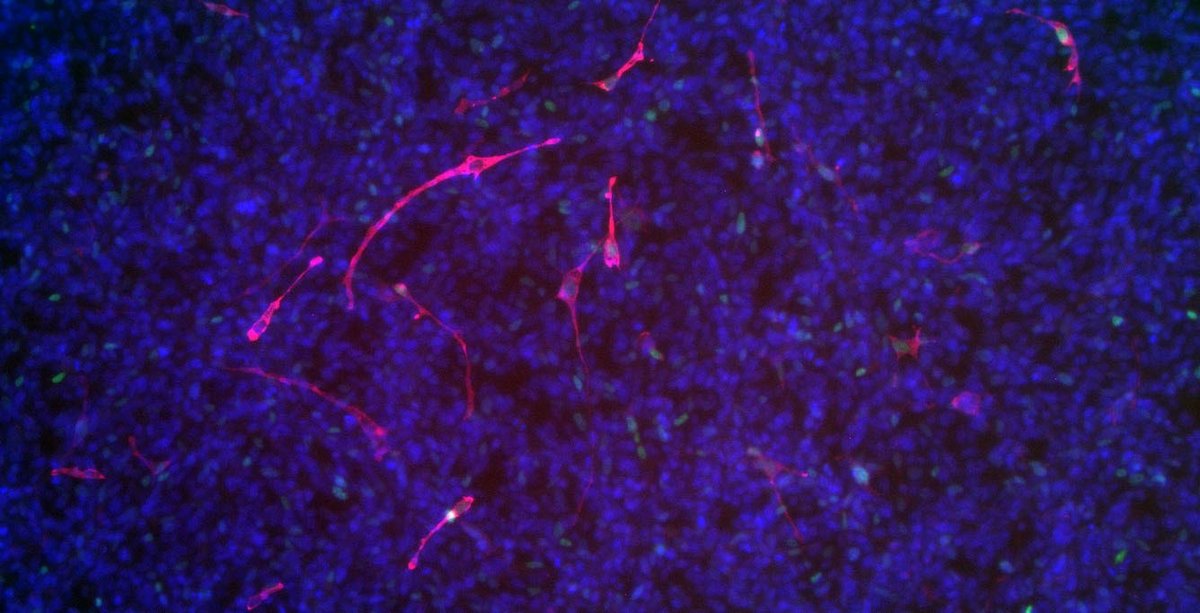
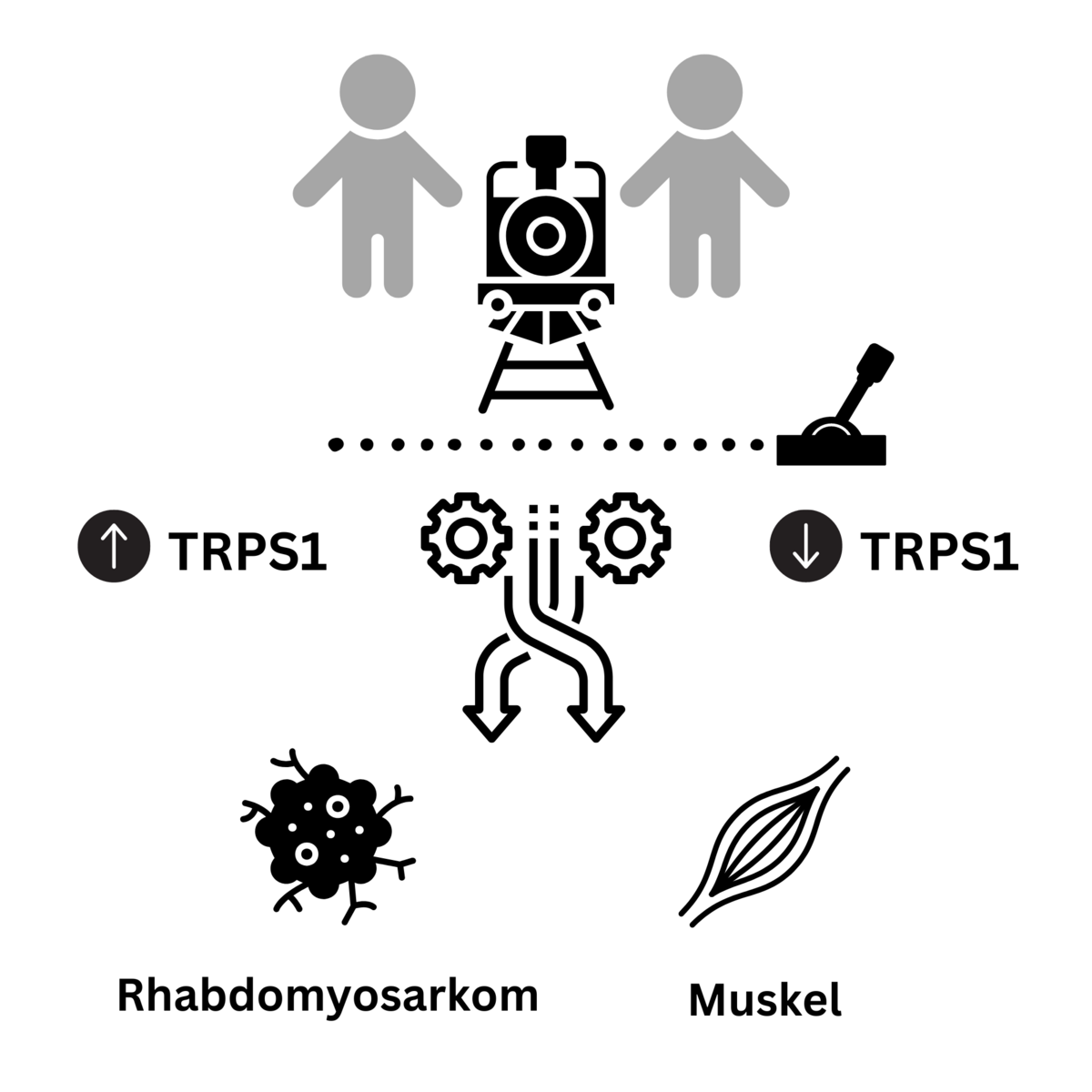
„Durch unsere Studien an humanen Tumorzellen des embryonalen Rhabdomyosarkoms fanden wir heraus, dass der transkriptionelle Repressor TRPS1, ein Protein, das an die DNA binden und so das Ablesen der Gene unterdrücken kann, konstant erhöht ist“, erläutert Prof. von Maltzahn. Dieser erhöhte TRPS1-Spiegel führt im Muskelgewebe zu einer gestörten Differenzierung der Stammzellen und in den embryonalen Rhabdomyosarkom-Zellen zu einem vermehrten Wachstum der Zellen, was folglich das Tumorwachstum begünstigt.
Einfluss des TRPS1-Spiegels auf Differenzierung der Stammzellen
„Bei der normalen Entstehung und Entwicklung der Skelettmuskulatur muss der TRPS1-Spiegel in den Zellen zu Beginn der Differenzierung herunterreguliert sein, da nur so ein gezielter Aufbau und Wachstum der Muskeln möglich ist,“ ergänzt Dr. Sören S. Hüttner, der die Studien während seiner Doktorarbeit am FLI durchführte. Doch welche genaue Rolle spielt TRPS1 bei der myogenen Differenzierung?
Die Forschenden fanden heraus, dass bei einem übermäßigen Vorhandensein von TRPS1 in normalen Muskelzellen die Muskelbildung (Myogenese) stark beeinträchtigt wird, ähnlich, wie das auch bei der Tumorerkrankung zu beobachten ist. „Der erhöhte TRPS1-Spiegel scheint also einer der Hauptinhibitoren der terminalen myogenen Differenzierung zu sein, der die Entstehung und Entwicklung der Skelettmuskulatur stört“, berichtet Prof. von Maltzahn. „Das führte uns zu der Idee, dass wir durch Reduktion der TRPS1-Menge in den Tumorzellen eventuell das Tumorwachstum vermindern können.“
Umprogrammierung – Tumorzelle wird wieder zur Muskelzelle
Durch die Zusammenarbeit mit Dr. Björn von Eyss vom FLI und Prof. Ursula Anderer von der BTU und mit Hilfe verschiedener Methoden (z.B. shRNAs, Crispr/Cas9) gelang den Forschenden tatsächlich – sowohl in Zellkultur als auch im Mausmodell – der Nachweis, dass sich durch die gezielte Absenkung des TRPS1-Spiegels in den Tumorzellen die Differenzierung der Zellen verändern lässt: Aus den Tumorzellen werden Muskelzellen, d.h. dort, wo vorher ein Tumor vorhanden war, entstehen Muskelzellen, die nicht mehr weiterwachsen können.
Neuartiger Behandlungsansatz für Weichteiltumore
„Anhand dieser erfolgversprechenden Ergebnisse glauben wir, einen wirkungsvollen, neuartigen therapeutischen Ansatz zur Behandlung von embryonalen Rhabdomyosarkomen gefunden zu haben, mit dem man zukünftig – neben Chemo- und Strahlentherapie – das Wachstum und die Ausbreitung des Tumors stoppen könnte“, unterstreicht Dr. Hüttner die Relevanz der Ergebnisse.
Es ist davon auszugehen, dass die Forschungsergebnisse weitreichende Auswirkungen auf die Krebsforschung, insbesondere auf die Untersuchung von Weichteiltumoren bei Kindern und die Entwicklung neuer Strategien zur Behandlung von Rhabdomyosarkomen haben werden. Alles deutet darauf hin, dass TRPS1 ein vielversprechendes therapeutisches Ziel mit hohem Potential ist, um Tumorzellen in Muskelzellen zu verwandeln, die sich nicht mehr teilen können und damit zum Stopp des Tumorwachstums beitragen.
Publikation
A dysfunctional miR-1-TRPS1-MYOG axis drives ERMS by suppressing terminal myogenic differentiation. Hüttner SS, Henze H, Elster D, Koch P, Anderer U, von Eyss B, von Maltzahn J. Mol Ther. 2023, S1525-0016(23)00383-0. doi: 10.1016/j.ymthe.2023.07.003.
Das Projekt „Driving rhabdomyosarcoma into differentiation“ wurde im Rahmen von SPARK-FLI von 2020 bis 2021 gefördert. Das interne Technologietransferprogramm SPARK-FLI hilft dabei, grundlegende wissenschaftliche Erkenntnisse aus der biomedizinischen Forschung in die Diagnostik oder medizinische Anwendung zu übertragen und stellt sicher, dass die staatlich finanzierte Forschung zu einer verbesserten Gesundheit unserer Gesellschaft beiträgt. Durch diese gezielte Förderung erhöhen sich nicht nur die Erfolgsaussichten des jeweiligen Forschungsprojektes, auch die Kosten sowie der Zeitaufwand zur Erreichung des Ziels werden gesenkt.
Hintergrundinformation
Das Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena widmet sich seit 2004 der biomedizinischen Alternsforschung. Rund 350 Mitarbeiter*innen aus ca. 40 Nationen forschen zu molekularen Mechanismen von Alternsprozessen und alternsbedingten Krankheiten.
Die Leibniz-Gemeinschaft verbindet 97 eigenständige Forschungseinrichtungen. Ihre Ausrichtung reicht von den Natur-, Ingenieur- und Umweltwissenschaften über die Wirtschafts-, Raum- und Sozialwissenschaften bis zu den Geisteswissenschaften. Leibniz-Institute widmen sich gesellschaftlich, ökonomisch und ökologisch relevanten Fragen. Sie betreiben erkenntnis- und anwendungsorientierte Forschung, auch in den übergreifenden Leibniz-Forschungsverbünden, sind oder unterhalten wissenschaftliche Infrastrukturen und bieten forschungsbasierte Dienstleistungen an. Die Leibniz-Gemeinschaft setzt Schwerpunkte im Wissenstransfer, vor allem mit den Leibniz-Forschungsmuseen. Sie berät und informiert Politik, Wissenschaft, Wirtschaft und Öffentlichkeit. Leibniz-Einrichtungen pflegen enge Kooperationen mit den Hochschulen – in Form der Leibniz-WissenschaftsCampi, mit der Industrie und anderen Partnern im In- und Ausland. Die Leibniz-Institute unterliegen einem transparenten und unabhängigen Begutachtungsverfahren. Aufgrund ihrer gesamtstaatlichen Bedeutung fördern Bund und Länder die Institute der Leibniz-Gemeinschaft gemeinsam. Die Leibniz-Institute beschäftigen rund 20.500 Personen, darunter 11.500 Wissenschaftlerinnen und Wissenschaftler. Das Finanzvolumen liegt bei zwei Milliarden Euro.
Die Brandenburgische Technische Universität Cottbus-Senftenberg (BTU) ist eine junge Universität, die sich den aktuellen wissenschaftlichen Herausforderungen stellt. Die zweitgrößte Hochschule und einzige Technische Universität des Landes Brandenburg bietet ein bundesweit einmaliges Portfolio an über 60 Studiengängen, darunter duale und internationale Studiengänge. Von den rund 6.800 Studierenden kommen ca. 40 Prozent aus über 120 verschiedenen Ländern. In ihrer Forschung legt die BTU den Fokus auf die vier Profillinien: „Energiewende und Dekarbonisierung“, „Globaler Wandel und Transformationsprozesse“, „Gesundheit und Life Sciences“ sowie „Künstliche Intelligenz und Sensorik“. Auf dieser Grundlage erarbeitet die Universität mit ihrer wissenschaftlichen Expertise praxisrelevante Lösungen für die Gestaltung der großen Zukunftsthemen weltweit. Interdisziplinäre Cluster und enge Kooperationen mit ihren Partnern in Wissenschaft und Wirtschaft ermöglichen Profilierung und internationale Anschlussfähigkeit. Unter Federführung der BTU soll im Lausitz Science Park in den nächsten Jahren am Standort Cottbus eine Innovationslandschaft mit internationaler Strahlkraft entstehen, die Spitzenforschung und Transfer nachhaltig bündelt.
Fachkontakt
Stammzellbiologie des Alters
T +49 (0) 3573 85 526
Julia.vonMaltzahn(at)b-tu.de
Pressekontakt