Tissue Engineering von in vitro Knorpelgewebe für eine Zellbasierte Therapie
Zellbasierte Therapien zur Wiederherstellung funktionaler Gewebe sind das primäre Ziel der Regenerativen Medizin. Dies kann durch Applikation von Einzelzellen in Suspension oder durch Transplantation von bereits in vitro hergestellten Geweben erreicht werden.
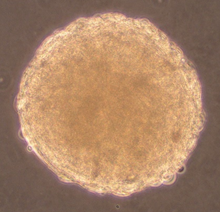
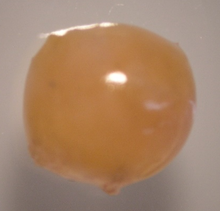
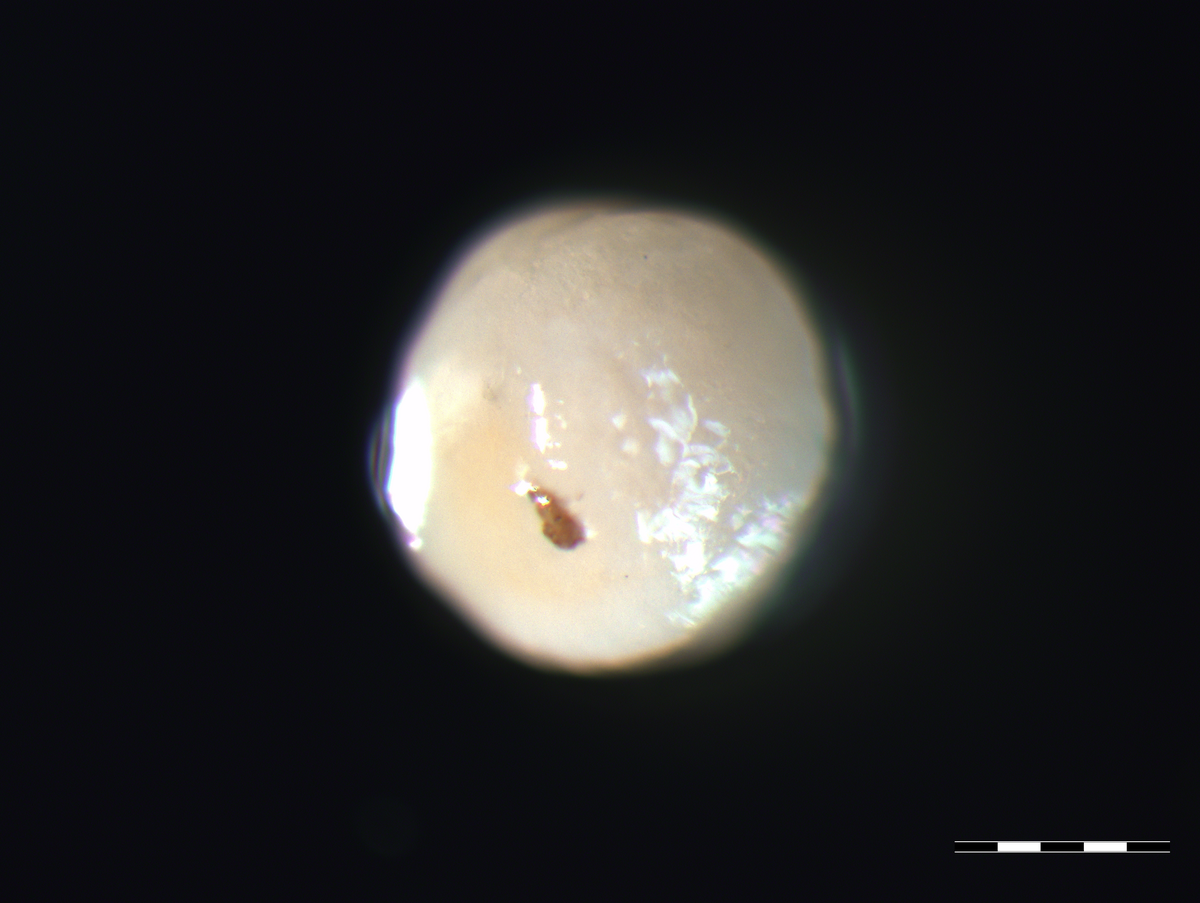
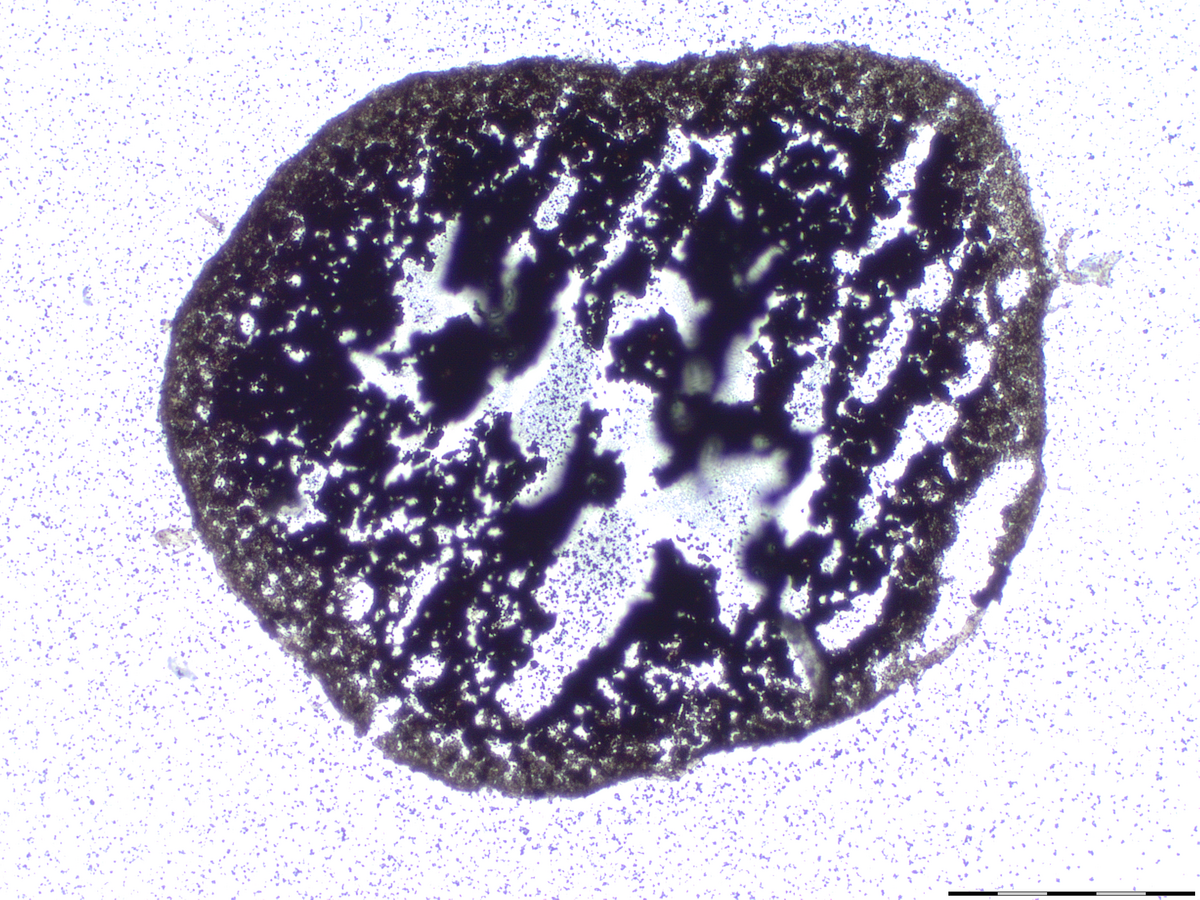
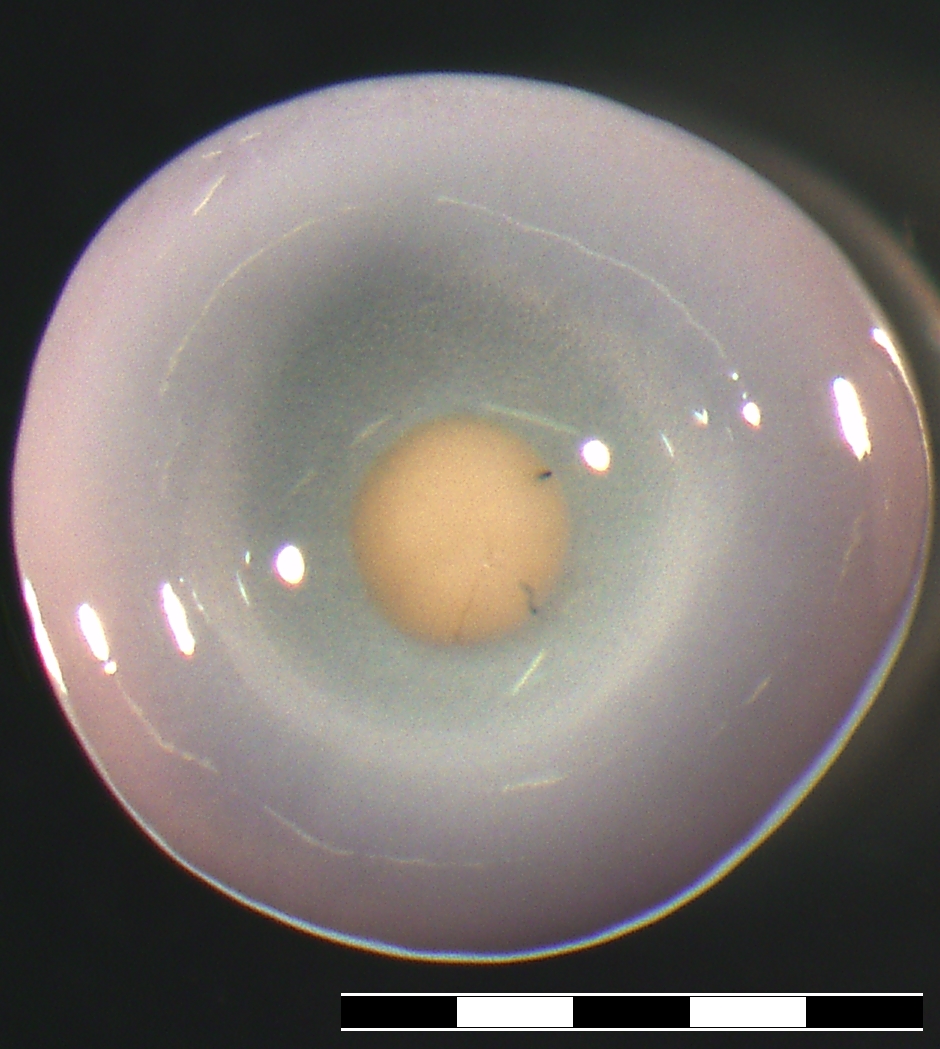
Knorpel- und Knochengewebe sind wichtige Komponenten in unseren Gelenken. Traumatische Verletzungen werden häufig durch sportliche Aktivitäten wie z. B. Fußball, Skifahren verursacht. Werden solche Knorpelschäden nicht behandelt, besteht ein hohes Risiko, dass hierdurch eine Arthrose entstehen kann. Aufgrund der fehlenden Selbstheilungskapazität von Knorpel besteht ein hoher Bedarf an neuen therapeutischen Ansätzen zur Knorpelregeneration. Forschungs- und Entwicklungsziel ist die Optimierung des Herstellungsprozesses von „Microtissues“ zur Regeneration von Knorpelschäden (z.B. Traumata, Arthrose) durch körpereigene Zellen. Herausforderungen hierbei sind die Kultivierung von frisch aus Gelenkknorpel isolierten Zellen (primary cells), deren Proliferation in Kultur sowie die chondrogene Differenzierung im „Microtissue“. Die Herstellung der in vitro Gewebe erfolgt ohne Trägermaterialien, um ein rein autologes Produkt zu generieren.
Eignet sich diese Therapie auch für ältere Menschen?
Zellbasierte Verfahren sind bei jungen Menschen heute oft die erste Wahl, viele klinische Studien werden weltweit durchgeführt. Jedoch werden diese Therapien nur bei Personen bis ca. 50 Jahre durchgeführt. Ungelöste Probleme für eine Anwendung dieser Therapie für ältere Patienten sind u.a. die Frage nach der Proliferationskapazität und Differenzierungsfähigkeit der Zellen. Eigene Vorarbeiten zeigen, dass Zellen aus Knorpel älterer Personen kultivierbar sind und so eine potentielle Quelle für zellbasierte Therapien darstellen.
Lässt sich humanes Serum im Medium ohne Differenzierungsverluste ersetzen?
Für unsere humanzellbasierten Experimente nutzen wir primär humanes Serum als Medienzusatz. Obwohl das humane Serum der physiologischen Umgebung in vivo am besten entspricht, ist es komplex, undefiniert und chargenabhängig. Aus diesem Grund testen wir verschiedene Serumersatzprodukte, die streng definiert zusammengesetzt sind. Hierdurch erwarten wir eine höhere Reproduzierbarkeit unserer Experimente.
Eignet sich unsere Knorpel-Technologie auch zur Herstellung von Knochen-Minigeweben?
In der Forschung werden verschiedene Ansätze verfolgt um mit Hilfe von Knochenzellen (hauptsächlich Osteoblasten und ihre Vorläuferzellen) die typische mineralisierte Matrix zu generieren. Dabei werden entweder die Zellen in Trägermaterialien oder als Monolayer differenziert. Bisher gibt es keine gerüstfreien Minigewebe entsprechend dem von uns entwickelten Knorpelminigeweben (s.o.).
Herausforderung hierbei ist die unterschiedliche Art der Matrixproduktion von Knochenzellen im Vergleich zu Knorpelzellen. Bei Knorpelzellen ist die Aggregation ein wichtiger Startpunkt für die chondrogene Differenzierung. Knochenzellen, andererseits, produzieren ihre mineralisierte Matrix über Apposition. Somit muss die Differenzierung der Knochenzellen mittels Aggregation als Startpunkt so optimiert werden, dass sie ebenfalls intrinsisch die knochentypische Matrix produzieren.
Weitere Herausforderung ist die zeitintensive Isolation der Knochenzellen. Gerade im Hinblick auf eine mögliche Ko-Kultur von Knochen- und Knorpelzellen von demselben Patienten muss diese Isolation optimiert werden.
Entwicklung eines osteochondralen in vitro Gewebemodells
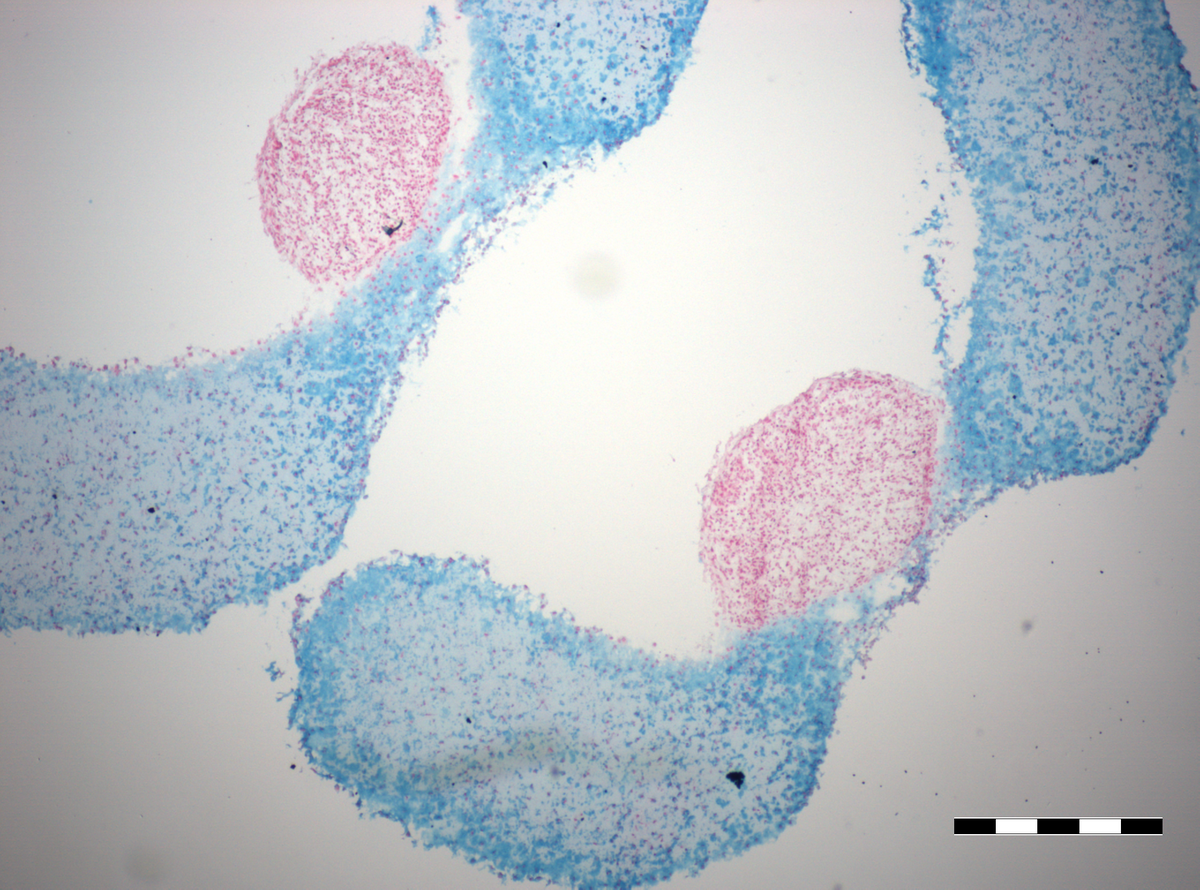
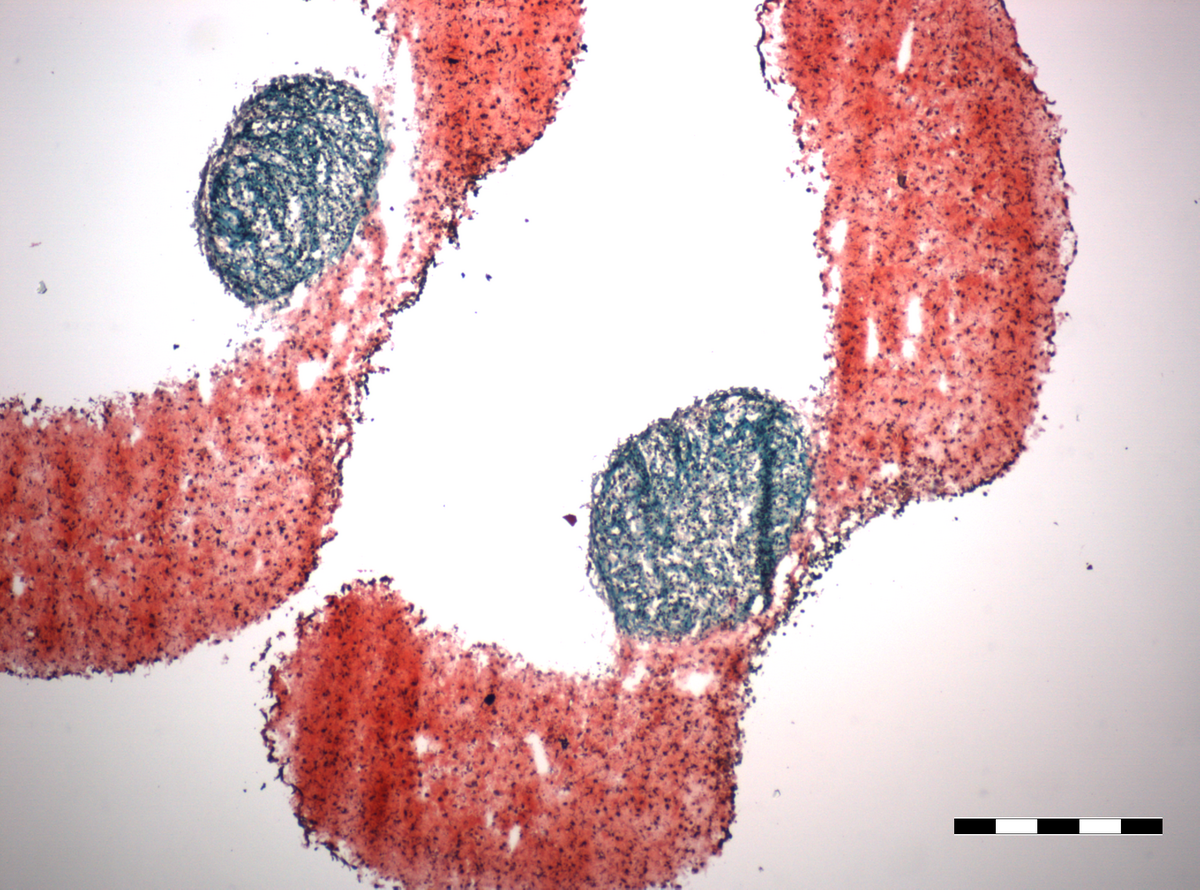
Neben reinen Knorpel- bzw. Knochenschäden gibt es gerade in Gelenken auch tieferliegende Verletzungen, die beide Gewebe betreffen. Aber auch bei bestimmten Erkrankungen wie Osteochondritis dissecans sind oft beide Gewebe betroffen. Diese Verletzungen können mittels der Mosaikplastik behandelt werden, bei der Knorpel-Knochenzylinder in den Defekt transplantiert werden. Jedoch müssen dem Patienten hierfür diese osteochondralen Zylinder aus unbelasteten Bereichen des Gelenks entnommen werden. Unser Ziel ist es, „Microtissues“ aus Knorpelzellen mit „Microtissues“ aus Knochenzellen nach optimaler chondrogener bzw. osteogener Differenzierung im Verbund zu kultivieren und osteochondrale Transplantate zu generieren. Herausforderung hierbei ist es, ein gemeinsames Medium zu finden, welches sowohl die chondrogene als auch die osteogene Differenzierung unterstützt.
Die Etablierung von Kokultivierungstechniken mit „Microtissues“ beider Zelltypen ist u.a. das Ziel unserer Doktorandin Annemarie Ecke im Rahmen ihrer Dissertation innerhalb des GRS Clusters „REGproAGE“.