Chemie der Silane
Die Chemie der Silane bildet die Grundlage für die Erzeugung von Halbleitersilicium für die Mikroelektronik, für die Gewinnung von Silicium für die Photovoltaik und für die Herstellung einer extrem breiten Palette von Silicon-Verbindungen, die alle Bereiche des Lebens und der Technik durchdringen.
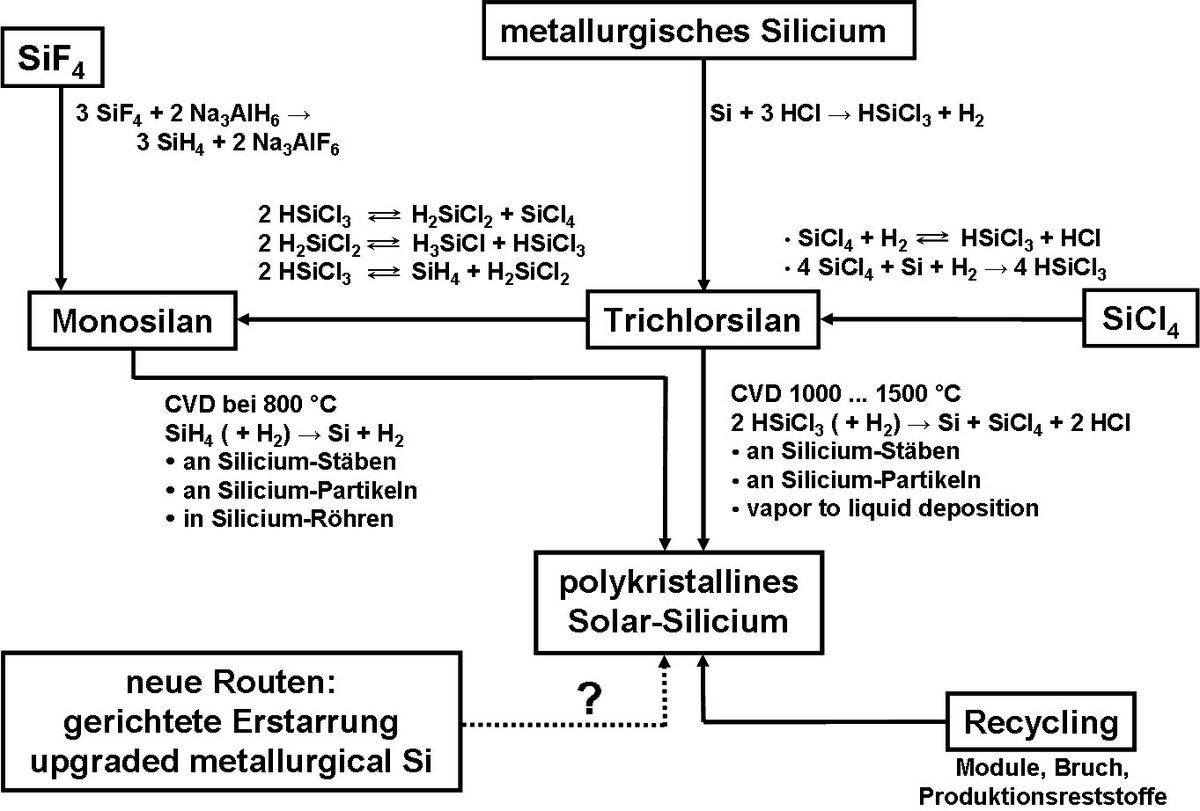
Besonders die Photovoltaik hat zu einer stürmischen Entwicklung der industriellen Silanchemie geführt, um ausreichend preiswertes Silicium für die Solarzellenproduktion bereitzustellen. Abbildung 1 gibt einen Überblick über die aktuellen Prozesse der industriellen Siliciumchemie zur Herstellung von Solarsilicium, die auch andere interessante Verfahren, wie die gerichtete Erstarrung, die chemische Reinigung von Silicium und Recyclingprozesse umfasst.
Die industrielle Silanchemie umfasst eine Reihe von Reaktionen, die auf Grund der wirkenden Prinzipien in enger Verwandtschaft zueinander stehen. Trotz jahrzehntelanger Forschungen sind die Reaktionsmechanismen der Silanchemie bis heute noch nicht vollständig verstanden. Daher sind sie immer wieder Gegenstand grundlegender Forschungsarbeiten.
Anstelle einer Darlegung der eigenen Forschungsarbeiten soll eine vereinfachte Darstellung der Thematik gegeben werden.
Die als Direkte Synthese oder auch als Müller-Rochow-Reaktion benannte Umsetzung von Silicium mit Methylchlorid (Gl. 1) kann als der wichtigste großtechnische Prozess der industriellen Siliciumchemie bezeichnet werden.

Hierbei wird gasförmiges Monochlormethan (Methylchlorid) bei Temperaturen um ca. 300 °C mit Silicium zur Reaktion gebracht, dem Kupfer und weitere Metallverbindungen zugesetzt wurden. Neben dem Zielprodukt Dimethyldichlorsilan entstehen Methyltrichlorsilan und Trimethylchlorsilan sowie eine Reihe niedrigsiedender Verbindungen.


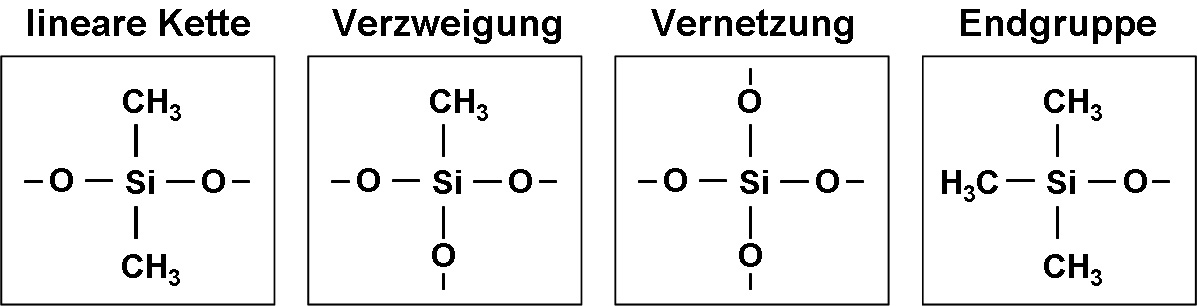
Ausgehend von den Methylchlorsilanen können - ähnlich einem Baukastenprinzip - Grundbausteine für den Aufbau von polymeren Siliconverbindungen mit teilweise komplexen dreidimensionalen Strukturen hergestellt werden (Abb. 2).
Die Direkte Synthese führt nur dann zu den gewünschten Produkten in hohen Raum-Zeit-Ausbeuten, wenn neben dem vorgelegten Silicium bestimmte Metalle anwesend sind. Im industriellen Maßstab werden die erforderlichen Metallgehalte durch Zugabe von Kupfer bzw. Kupferverbindungen zum Silicium, der sogenannten Kontaktmasse, gewährleistet. Hierin liegt das grundlegende Prinzip aller direkten Reaktionen von Silicium (hierunter zählt auch die Umsetzung von Silicium mit Chlorwasserstoff oder mit Alkoholen): Die Steuerung der Reaktivität des eingesetzten Siliciums durch Metalle.
Die Gegenwart von Metallen beeinflusst sowohl die Reaktionstemperatur wie auch die Produktverteilung und die Ausbeute in entscheidendem Maße. So wird das industriell bedeutsame Dimethyldichlorsilan, das in Abwesenheit von Metallen nicht gebildet wird, nur in Anwesenheit von Kupfer und meist zusätzlich unter Einsatz geeigneter Promotoren wie Zink oder Zinn in Ausbeuten zwischen 75 % und 95 % erhalten.
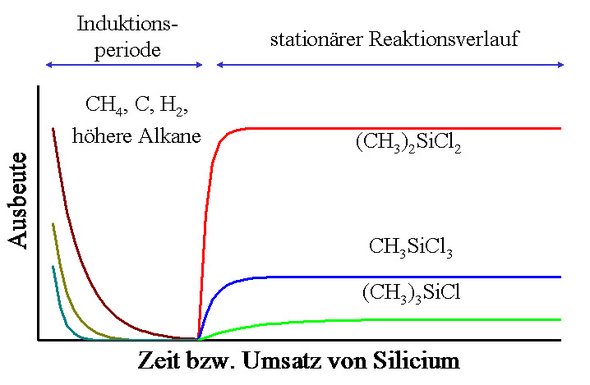
Ein weiteres interessantes Merkmal der Direkten Reaktionen ist eine mehr oder weniger stark ausgeprägte Induktionsperiode (Abb. 3), in der die entstehenden gasförmigen Reaktionsprodukte in ihrer Art und ihrem Anteil sehr unterschiedlich von der Produktverteilung in der stationären Periode der Reaktion ausfallen können. Das Auftreten einer Induktionsperiode, ihre Dauer und die darin auftretende Produktverteilung hängen von den zugegebenen Metallen und deren Zustand ab. Letzterer wird wiederum von den Reaktionsbedingungen während der Induktionsperiode und zusätzlich von den häufig durchgeführten Aktivierungsschritten vor der eigentlichen Umsetzung bestimmt.

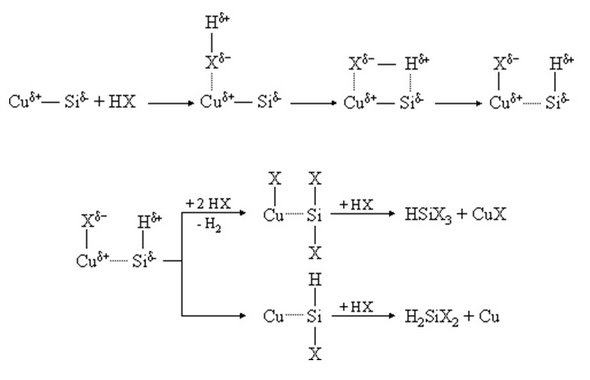
Der Mechanismus der Direkten Synthese ist bis heute nicht vollständig verstanden. Die umfassendste und heute allgemein akzeptierte Interpretation geht auf die Arbeiten von K. M. Lewis zurück. Aufbauend auf dem massenspektroskopischen Nachweis des Methylchlorsilylens (CH3SiCl) formulierten Lewis et al. [1] erstmals einen Silylenmechanismus zur Direkten Synthese (Abb. 4).
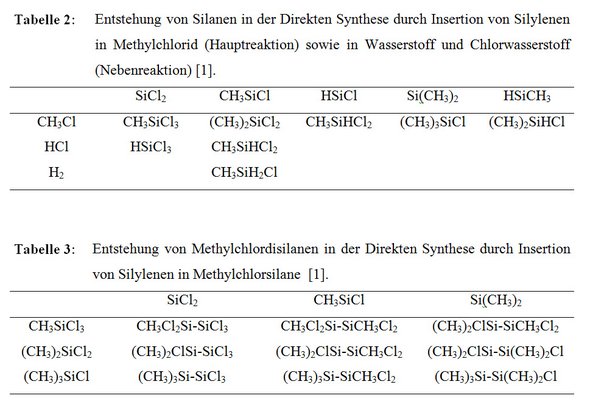
Dieses Modell beschreibt den Reaktionsverlauf als Insertion oberflächlich gebundener Silylene in adsorbierte Eduktmoleküle. Dabei wird vorausgesetzt, dass die Silylene durch ein Substrat, d.h. durch die Kontaktmasse oder den Katalysator, entsprechend stabilisiert werden. Diesem Mechanismus zufolge werden alle primären Hauptprodukte durch Insertion der Silylene CH3SiCl, SiCl2, Si(CH3)2, HSiCl und CH3SiH in die C-Cl-Bindung von adsorbiertem Methylchlorid gebildet (Tab. 2). Disilane entstehen durch Insertion der Silylene in die primär entstandenen Silane (Tab. 3).
Nach Lewis et al. führt die Gegenwart von Kupfer führt zur Bildung von Cu-Si-Bindungen, die durch Elektronenübergang vom Kupfer auf Silicium und eine Rückbindung von Si(3p) auf Cu(3d) gebildet wird, wodurch die Rückbindung der Siliciumoberflächenatome zur Volumenphase geschwächt wird. Liegen infolge der Chemisorption von Methylchlorid CH3SiCl-Silylene vor, tritt das Elektronenpaar des Singulett-Silylens CH3SiCl in Wechselwirkung mit dem teilweise gefüllten 4s-Orbitals des Kupfers, wobei ein freies p-Orbital am Si verbleibt. Dieses freie elektrophile Orbital des Silylens weist in Richtung der Gasphase, wo es zur Insertion in ein adsorbiertes Methylchloridmolekül bereitsteht.
Als Hydrochlorierung wird die Umsetzung von Silicium mit Chlorwasserstoff zu Trichlorsilan bezeichnet (Gl. 2).

Allerdings stellt Gl. 2 nur eine Vereinfachung dar, da als Nebenprodukte Siliciumtetrachlorid, Dichlorsilan sowie eine Vielzahl weitere Verbindungen, wie z.B. BCl3, B2H6, AsCl3, PCl3 oder POCl3 entstehen, die vor der weiteren Verwendung des Trichlorsilans in mehreren Reinigungsschritten destillativ entfernt werden müssen. Nach der Trennung wird hochreines Trichlorsilan erhalten, welches die Basis zur Gewinnung von Reinstsilicium für die Halbleiter- und Solarsiliciumproduktion bildet.
Eine treffendere Beschreibung der Hydrochlorierung wird durch (Gl. 3) gegeben.
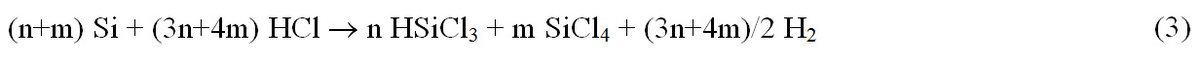
Die allgemeinen Erfahrungen besagen, dass (a) die Reaktion bei umso niedrigerer Temperatur einsetzt, je höher der Metallgehalt des verwendeten Siliciums ist und (b) die Selektivität der Reaktion bezüglich Trichlorsilan umso höher ist, je niedriger der Metallgehalt des Siliciums und je niedriger die Reaktionstemperatur ist. Diese zwei empirisch gefundenen Abhängigkeiten variieren in ihrem Ausmaß mit dem anwesenden Metall und dessen Gehalt im Silicium und zeigen für verschiedene Metalle zudem voneinander abweichende Temperaturabhängigkeiten.
Die anwesenden Metalle und die gewählte Reaktionstemperatur beeinflussen auch die Bildung der Nebenprodukte Siliciumtetrachlorid und Dichlorsilan. Je nach Wahl der Reaktionstemperatur und des Metallgehaltes im Silicium kann der Anteil an Dichlorsilan zwischen 0 und 18 % und der von Siliciumtetrachlorid 0 bis 30 % erreichen [2]. Andererseits können nur in Anwesenheit von Metallen eine hinreichende Reaktionsgeschwindigkeit und hinreichend niedrige Reaktionstemperaturen erzielt werden. Detaillierte Untersuchungen in der Arbeitsgruppe von Prof. H.A. Øye, Universität Trondheim, zeigten, dass die im Silicium enthaltenen intermetallischen Phasen die eigentlichen Reaktionszentren darstellen, die je nach Zusammensetzung jedoch ein unterschiedliches Reaktionsverhalten zeigen [3, 4]. Kinetische und thermodynamische Betrachtungen zur Reaktivität der silicidischen Phasen waren Gegenstand zahlreicher Untersuchungen [5-7].
Hochreines HSiCl3 wird in Gegenwart von Wasserstoff an 1000 °C heißen Siliciumstäben zu polykristallinem Silicium zersetzt. Anstatt der erwarteten 75 %igen Ausbeute an Silicium (bezogen auf Trichlorsilan) in Umkehrung von Gl. (2), werden auf Grund kinetischer Hemmungen nur Ausbeuten von ca. 25 % erreicht (Gl. 4).

Aus diesem Grund wird die Abscheidung in Gegenwart von Wasserstoff durchgeführt, um die Ausbeute an Silicium zu erhöhen (Gl. 5).
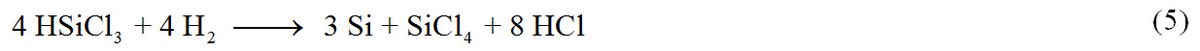
Das anfallende hochreine SiCl4 wird zu Kieselsäureverbindungen hydrolysiert oder, wie nachfolgend beschrieben, durch verschiedene Verfahren wieder in Trichlorsilan konvertiert.
Unter Konvertierung oder Hydrodechlorierung ist die Umsetzung von Siliciumtetrachlorid mit Wasserstoff zu Trichlorsilan zu verstehen (Gl. 6).

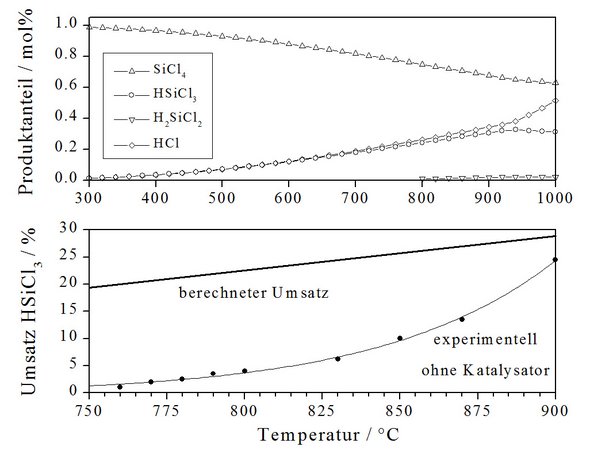
Die homogene Konvertierung von SiCl4 zu HSiCl3 erfordert Temperaturen von oberhalb 1000 °C, da kinetische Hemmungen bei der Gleichgewichtseinstellung erst dann wirtschaftlich vertretbare Trichlorsilanausbeuten zulassen. Abb. 5 zeigt die berechnete Temperaturabhängigkeit der Gleichgewichtszusammensetzung einer SiCl4/H2-Gasgemisch im molaren Verhältnis SiCl4 : H2 = 1 : 6, nach der bereits bei Raumtemperatur ein messbarer Umsatz in Trichlorsilan vorliegen sollte. Das Vorliegen kinetischer Hemmungen wird durch experimentelle Untersuchungen von Walter [8] und Röver [9] bestätigt, die einen messbaren Umsatz zu Trichlorsilan in Abwesenheit eines Katalysators erst oberhalb von ca. 750 °C feststellten.
Durch Anwendung hoher Wasserstoffüberschüsse gelingen HSiCl3-Ausbeuten von 20 - 35 %. Die Nachteile dieses Prozesses sind die entstehenden Nebenprodukte, die oberhalb 900 °C verstärkt gebildet werden (Dichlorsilan, Polychlorsilane) sowie die mit den hohen Reaktionstemperaturen eintretenden Materialbeanspruchung des Reaktors. Technisch werden die Korrosionsprobleme durch graphitausgekleidete Reaktoren gelöst.
Die Konvertierung von SiCl4 in HSiCl3 in Gegenwart von Silicium (Gl. 7) entspricht formal der Rückreaktion der Siliciumabscheidung nach Gl. 4. Diese Reaktion kann als Kombination aus Hydrochlorierung von Silicium (Gl. 3) und Hydrodechlorierung von Siliciumtetrachlorid (Gl. 6) aufgefasst werden. Technisch findet die Reaktion im Wirbelschichtreaktor bei Temperaturen zwischen 500 °C und 600 °C statt, die kontinuierlich mit Siliciumkörnern und Katalysatormetallen beschickt wird.

Bestimmend für den Reaktionsverlauf sind die an der Oberfläche der Siliciumkörner ablaufenden Reaktionen zwischen Metall, Silicium und Reaktionsgasphase, so wie in der Hydrochlorierung von Silicium [10-12]. Wird für die Hydrodechlorierung in Gegenwart von Silicium ein Eisenkatalysator eingesetzt, findet die Reaktion nur an den eisenhaltigen Stellen, die ungleichmäßig über die Oberfläche verteilt sind, und nicht am metallfreien Silicium statt [12]. Ein besonderes Charakteristikum für Eisen ist die Ausbildung von Ätzgruben (pits), an deren Boden stets Eisen nachweisbar ist [3, 4, 6], was durch die Entstehung lokaler Eisensilicidinseln und deren besonderes Reaktionsverhalten erklärbar ist [7]. Wird anstelle von Eisen Kupfer verwendet, verteilt dieses sich so stark über die Siliciumoberfläche, dass isolierte Ätzgruben nicht mehr nachweisbar sind. Als Folge dessen findet eine nahezu gleichmäßige Reaktion an der gesamten Siliciumoberfläche statt [12].
Da die Reaktion unter Abnahme des Reaktionsvolumens verläuft, wird die Reaktion meist unter einem Druck bis zu 30 bar geführt. Bei 30 bar und Verwendung eines Kupferkatalysators können bei 600 °C praktische Trichlorsilanausbeuten von ca. 28 % erreicht werden (Abb. 6). Der maximale thermodynamisch berechnete Umsatz wird erst bei unwirtschaftlich langen Verweilzeiten erreicht. Ebenso wie die Hydrochlorierung erfordert die Hydrodechlorierung eine Induktionsperiode, die durch die Verwendung des Kupferkatalysators und darüber hinaus durch Zugabe von Chlorwasserstoff auf ca. ein bis zwei Stunden begrenzt werden kann [12].
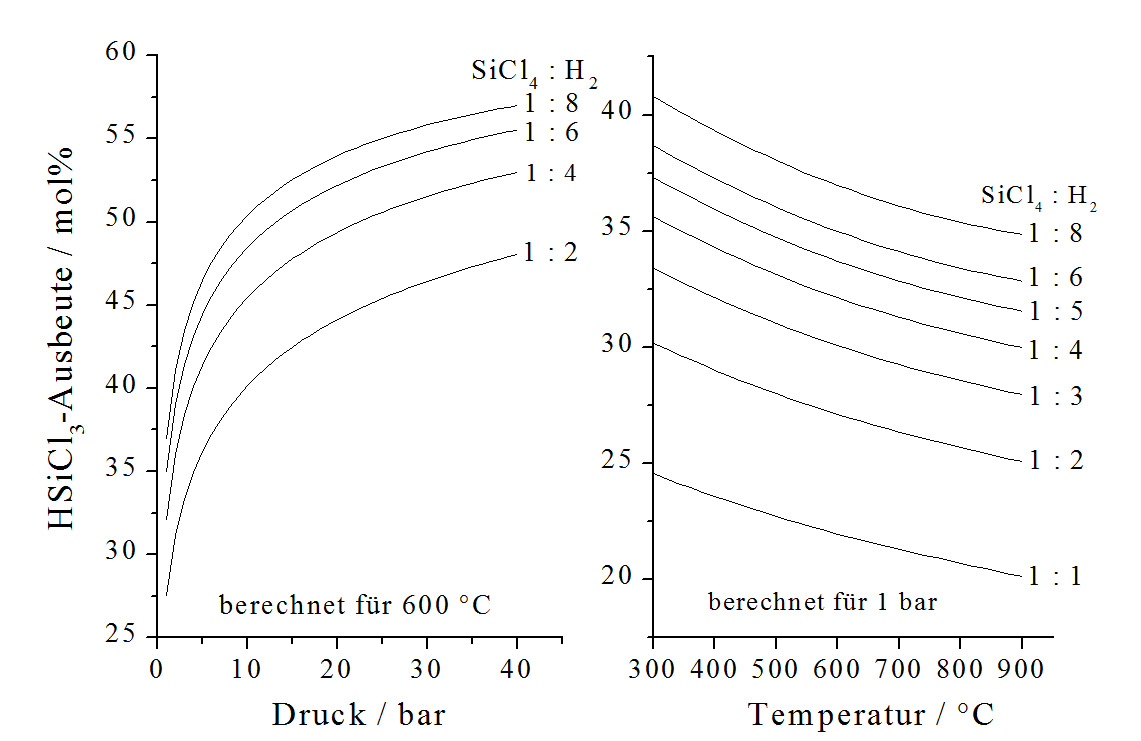
Die Grundlagen der katalytischen Hydrodechlorierung von Siliciumtetrachlorid in Gegenwart von Übergangsmetallsiliciden wurden durch Roewer, Walter und Bohmhammel in den Jahren 1992 bis 1996 geschaffen [13-16]. Die praktischen Vorteile dieser Reaktion liegen in den niedrigen Reaktionstemperaturen von 600 °C bis 900 °C und der sehr hohen Selektivität für Trichlorsilan.
In einem ersten Schritt, der Katalysatorformierung, wird ein vorgelegtes Übergangsmetall mit einem SiCl4/H2-Gasgemisch (Gl. 8) in ein Silicid überführt.
Wesentlichstes Merkmal dieser Reaktion ist ihr streng thermodynamischer Verlauf, der unter den gegebenen Reaktionsbedingungen wie Temperatur, Druck, Gasphasenzusammensetzung immer zur thermodynamisch stabilsten Silicidphase führt.
Bereits während der Silicidphasenbildung setzt der zweite Schritt, die Bildung von Trichlorsilan, ein (Gl. 9).

Die Entstehung von Trichlorsilan nach Gl. 9 beginnt unmittelbar mit dem Beginn der Silicidierung und nimmt mit der voranschreitenden Silicidbildung immer weiter zu. Die Voraussetzung für eine stationär ablaufende Hydrodechlorierung mit gleich bleibender Trichlorsilanausbeute ist erreicht, wenn das eingesetzte Metall entsprechend Gl. 8 vollständig zum Silicid umgesetzt ist und die unter den jeweiligen Reaktionsbedingungen (Metall, Temperatur, Eduktgasverhältnis) thermodynamisch stabile Silicidphase, zumindest an der Katalysatoroberfläche, vorliegt [9, 17].
Literatur
| [1] | K.M. Lewis, D. McLeod, B. Kanner, J.L. Falconer, T.C. Frank in: K.M. Lewis, D.G. Rethwisch (Eds.) Catalyzed Direct Reactions of Silicon; Series: Studies in Organic Chemistry 49; Elsevier: Amsterdam, 1993, 333. |
| [2] | H. Ehrich, D. Born, J. Richter-Mendau, H. Lieske, Appl. Organomet. Chem. 12 (1998) 257. |
| [3] | G.J. Andersen, H.A. Øye, J.O. Hoel in: Silicon for the Chemical Industry V, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 2000, 193. |
| [4] | T. Buseth, A.G. Forwald, H.M. Rong, B. Skofteland, H. Sørheim, J.O. Hoel in: Silicon for the Chemical Industry V, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 2000, 135. |
| [5] | J. Acker, K. Bohmhammel, G. Roewer in: Silicon for the Chemical Industry IV, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 1998, 133. |
| [6] | J. Acker, I. Röver, G. Roewer, K. Bohmhammel in: Silicon for the Chemical Industry V, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 2000, 121. |
| [7] | J. Acker, K. Bohmhammel, J. Phys. Chem. B 106 (2002) 5105. |
| [8] | H. Walter, Dissertation, TU Bergakademie Freiberg, 1995. |
| [9] | I. Röver, Dissertation, TU Bergakademie Freiberg, 2002. |
| [10] | "Gewinnung von Precursor-Verbindungen zur Reinstsiliciumherstellung" J. Acker, G. Roewer, I. Röver, K. Bohmhammel, Freiberger Forschungshefte, B327 "Freiberger Siliciumtage 2003: Halbleitermaterialien, Prozesstechnologie und Diagnostik", Hrsg.: H.-J. Möller, G. Roewer, 2004, S. 21. |
| [11] | T. Sill, S. Buchholz, R. Weber, L. Mleczko in: Silicon for the Chemical Industry V, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 2000, 107. |
| [12] | T. Sill, Dissertation, Ruhr-Universität Bochum, 2001. |
| [13] | H. Walter, U. Pätzold, G. Roewer, DE 4343 169 A1, 1993. |
| [14] | H. Walter, Dissertation, TU Bergakademie Freiberg, 1995. |
| [15] | K. Bohmhammel, G. Roewer, H. Walter, J. Chem. Soc. Faraday Trans. 1995, 91, 3879. |
| [16] | H. Walter, G. Roewer, K. Bohmhammel, J. Chem. Soc. Faraday Trans. 92 (1996) 4605. |
| [17] | J. Acker, K. Bohmhammel, K. Hesse, U. Pätzold, G. Roewer, I. Röver in: Silicon for the Chemical Industry VI, Eds.: H.A. Øye, H.M. Rong, L. Nygaard, G. Schüssler, J. Kr. Tuset, The Norwegian University of Science and Technology, Trondheim, Norway, 2002, 209. |