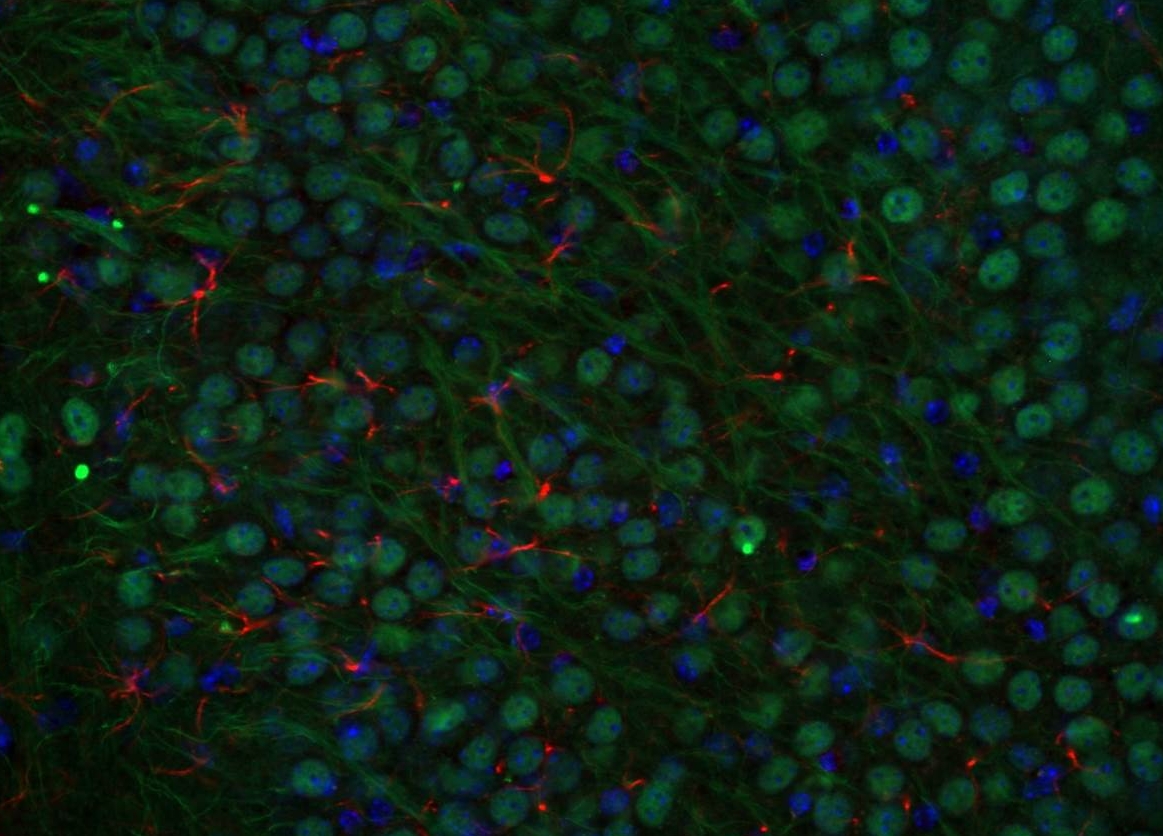
Neuronale Erkrankungen im Alter könnten mit einem mangelhaften Proteinabbau zusammenhängen
Zelluläre Eigenschaften basieren auf Proteinen, deren Synthese, Faltung, Modifikation und Abbau einer Qualitätskontrolle unterliegen. Gealterte Proteine werden erkannt, markiert und durch zelluläre »Proteinmülltonnen« (Proteasen) unschädlich gemacht. Im Alter kann es passieren, dass diese körpereigene Qualitätskontrolle nicht mehr fehlerfrei funktioniert. Ansammlungen von Proteinen und Proteinfragmenten (Peptide) an und in Nervenzellen sind dann die Folge. Die Zusammenlagerung dieser Peptide bedingt zum Beispiel das Absterben von Neuronen durch Apoptose (eine der zahlreichen Varianten des Zelltods) bei der Alzheimer-Erkrankung. Die normalen Abbauprozesse für Proteine im Gehirn, wie auch pathologische Veränderungen der Abbaukompetenz im Alter und bei neuronalen Erkrankungen (Neurodegeneration, neuronale Tumore) sind ein wichtiges Forschungsfeld, das Prof. Dr. Ralf Stohwasser vom Fachgebiet Biochemie bearbeitet.
Im Mittelpunkt des Interesses steht die Mikroglia. Dabei handelt es sich um einen Bestandteil des Nervengewebes mit besonderen Funktionen. Mikroglia ist in der Lage, unterschiedliche Funktionszustände der Neuronen und wahrscheinlich auch anderer Zelltypen der Neuroglia zu messen. So kann die Mikroglia auf pathologische Veränderungen, wie z.B. die Folgen eines Schlaganfalls, schadensbegrenzend oder auch -verstärkend Einfluss nehmen. Deshalb geht es für die Forscherinnen und Forscher um Prof. Stohwasser zunächst darum, in einfachen Zellkulturmodellen (2D) eine Bestandsaufnahme der verschiedenen Komponenten und Aktivitäten der für den Proteinabbau zuständigen proteolytischen Systeme durchzuführen. Dabei zeigte sich bereits, dass »ruhende« Mikroglia unter normalen Bedingungen sogenannte Standardproteasomen besitzt, während »aktivierte« Mikroglia Immunoproteasomen mit anderen proteinabbauenden Eigenschaften besitzt. »Wir vermuten, dass Alterungsprozesse die Kapazität und Spezifität solcher proteolytischen Systeme verändert und einen Anteil an der Entstehung von Demenzerkrankungen haben könnte«, erklärt Prof. Stohwasser. Durch gezielte Modulation der Mikrogliafunktion könnten in Zukunft gewisse altersbedingte neurologische Leiden besser verstanden und möglicherweise gelindert werden.
Bevor es soweit ist, wollen Prof. Stohwasser und sein Team herausfinden, was genau während des Alterungsprozesses mit Neuronen und Gliazellen passiert. Dafür werden Alterungsbedingte Veränderungen gezielt durch geeignete Stressoren simuliert, um zu sehen, wie die »Proteinmülltonnen« der verschiedenen Zelltypen mit altersbedingte Schädigungen umgehen. Dazu bedarf es der Herstellung dreidimensionaler (3D) Zellkulturmodelle. Diese sind notwendig, weil sie die Simulation molekularer Prozesse in Geweben erlauben und die Abhängigkeit von tierexperimentellen Studien verringern. Außerdem können in 3D-Zellkulturmodellen pharmakologische Substanzen mit verbesserter Aussagekraft getestet werden. »Die 3D-Kulturen werden der tatsächlichen Struktur des Nervengewebes eher gerecht, als traditionelle 2D-Modelle. Wir hoffen, damit in Zukunft altersabhängige Fehlfunktionen von Gliazellen genauer identifizieren zu können. Auf dieser Basis können Pharmazeuten und Mediziner zukünftig gezielt Therapie- oder vielleicht sogar neue Präventionsformen entwickeln«, meint Prof. Stohwasser im Hinblick auf die langfristige Perspektive des Projekts.