Das nasschemische Ätzen von Silicium mit Flusssäure-Salpetersäure-Gemischen
Zur Reduktion der Salpetersäure
Das Auflösen von Silicium in konzentrieren HF/HNO3 Ätzlösung bei Raumtemperatur führt zu einer heftigen Entwicklung von braunen Stickoxidgasen (Abb. 1). Als einziges gasförmiges Reaktionsprodukt gemäß Gl. 1 sollte NO entstehen, welches mit Luftsauerstoff bei Raumtemperatur zu braunem NO2 oxidiert wird. Doch entweichen die beim Ätzen entstandenen Gase nicht vollständig aus der Ätzlösung. Die gute Löslichkeit von NO2 in Salpetersäure führt zur Gelb- bzw. Braunfärbung der Ätzlösung.

Wird der Auflöseprozess bei Temperaturen unter 15 °C durchgeführt, verfärbt sich die Ätzmischung zunächst nach grün und nimmt bei 1 °C eine himmelblaue Farbe an (Abb. 2). Im Vergleich zu Experimenten bei Raumtemperatur nimmt die Bildung des braunen Gases bis auf Spuren ab.

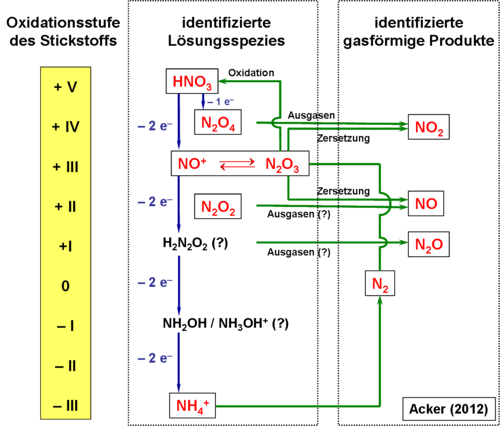
Abbildung 3 gibt einen Überblick über die im Rahmen unserer Forschungsaktivitäten und durch andere Gruppen gefundenen Stickstoffintermediate und die von uns vermuteten Reduktionswege der Salpetersäure. Alle in rot aufgeführten Spezies wurden durch verschiedene analytische Methoden nachgewiesen. Die Spezies in schwarzer Schrift stellen vermutete Intermediate oder Endprodukte dar, deren experimenteller Nachweis noch nicht gelungen ist.
In einem ersten Zweielektronenschritt erfolgt die Reduktion von HNO3 (N(V)) zu N(III)-Intermediaten wie N2O3, und [N4O62+], die untereinander im Gleichgewicht stehen. Das gelöste Distickstofftrioxid bewirkt die intensive Blauverfärbung der Ätzlösung. N2O3 zerfällt entweder in die Bestandteile NO und NO2 oder wird durch Luftsauerstoff oxidativ zu HNO3 abgebaut. Beim Verdünnen einer konzentrierten Ätzmischung wandeln sich alle vorliegenden N(III)-Intermediate vollständig in Nitritionen um, deren Gehalt mittels Ionenchromatographie bestimmt werden kann. Dies unterstreicht die Wichtigkeit der Nitritkonzentration als nützlichen Summenparameter zur Beschreibung der Reaktivität von Ätzmischungen in industriellen Anwendungen.
Die weitere Reduktion der in Lösung vorliegenden Spezies führt letztlich zur Bildung von Ammonium-Ionen. Damit ist zu vermuten, dass ein Teil der Intermediate sukzessive in drei aufeinanderfolgenden Zweielektronenschritten bis zur Oxidationsstufe -3 (NH4+) reduziert werden.